Основными этапами исследования являлись: выращивание штамма экстремальных галофильных бактерий H. halobium на синтетической среде с [2, 3, 4, 5, 6-2Н5]фенилаланином (0.26 г/л), [3, 5-2H2]тирозином (0.2 г/л) и [2, 4, 5, 6, 7-2H5]триптофаном (0.5 г/л), выделение фракции пурпурных мембран (ПМ), отделение от низко- и высокомолекулярных примесей, клеточной РНК, каротиноидов и липидов, фракционирование солюбилизированного в 0.5% ДДС-Na белка метанолом, гель-проникающая хроматография на сефадексе G-200, электрофорез в 12.5% ПААГ с 0.1% ДДС-Na (рис.2). Поскольку белок локализуется в ПМ, освобождение от низкомолекулярных примесей и внутриклеточного содержимого достигали осмотическим шоком клеток дистиллированной водой на холоду после удаления 4.3 М NaCl и последующим разрушением клеточной оболочки ультразвуком при 22 кГц. Последующую обработку клеточного гомогената РНК-азой I (2-3 ед. акт.) проводили для разрушения клеточной РНК. Поскольку фракция ПМ наряду с искомым белком в комплексе с липидами и полисахаридами содержала примесь связанных каротиноидов и посторонних белков, применялись специальные методы фракционирования белка без повреждения его нативной структуры и диссоциации, что существенно усложняло задачу выделения индивидуального БР с применением методов декаротинизации и делипидизации, а также очистки и колоночной хроматографии. Декаротинизация, заключающаяся в многократной обработке ПМ 50% этанолом при -50С, являлась рутинным, но обязательным этапом, несмотря на значительные потери хромопротеина. Использовалось не менее пяти обработок 50% этанолом, чтобы получить спектр поглощения суспензии очищенных от каротиноидов (4) и (5) ПМ (степень хроматографической чистоты 80-85%), показанного на рис. 3 на различных стадиях обработки (б) и (в) относительно нативного БР (а). Образование ретинальпротеинового комплекса в молекуле БР приводит к батохромному сдвигу в спектре поглощения ПМ (рис. 3, в) - основная полоса (1) при максимуме поглощения l 568 нм, вызванная световой изомеризацией хромофора по С13=С14-кратной связи определяется наличием транс-ретинального остатка ретиналя БР568, дополнительная малоинтенсивная полоса (2) при l 412 нм характеризует незначительную примесь образующейся на свету спектральной формы M412 c депротонированной альдиминной связью между остатком транс-ретиналя и белком, а полоса (3) при l 280 нм определяется поглощением ароматических аминокислот в полипептидной цепи белка (для чистого БR соотношение D280/D568 равно 1.5:1).
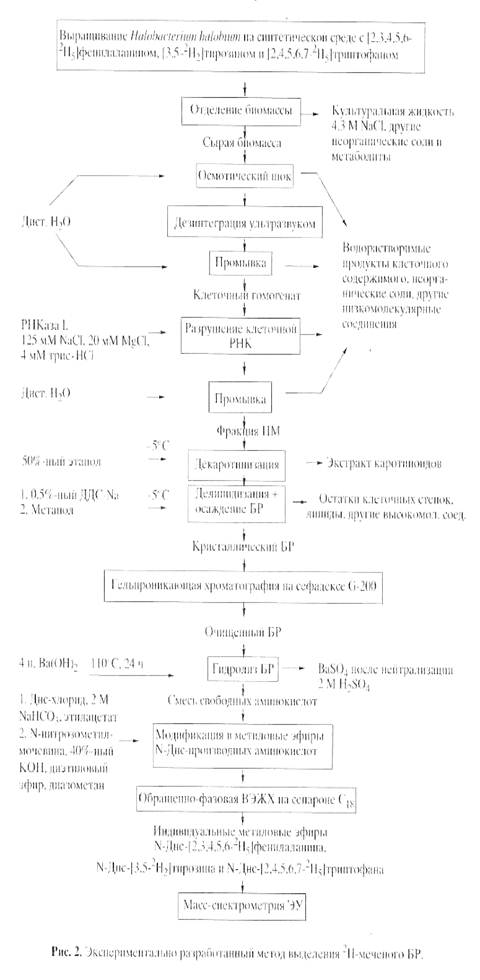
Фракционирование и тщательная хроматографическая очистка белка являлись следующим необходимым этапом. Поскольку БР, будучи трансмембранным белком (Мr 26.7 кД), пронизывает билипидный слой в виде семи a-спиралей, применение сульфата аммония и других традиционных высаливающих агентов не дает положительного результата. Решение проблемы заключалось в переводе белка в растворимую форму солюбилизацией в 0.5% ДДС-Na. Использование ионного детергента ДДС-Na диктовалось необходимостью максимальной солюбилизации белка с комбинированием стадии делипидизации и осаждения в нативном виде, поскольку солюбилизированный в слабоконцентрированном растворе ДДС-Na (0.5%) БР, сохраняет спиральную a-конфигурацию [9]. Поэтому отпала необходимость использования органических растворителей ацетона, метанола и хлороформа для очистки от липидов, а делипидизация и осаждение белка совмещались в одну единственную стадию, существенно упрощающую фракционирование. Значительным преимуществом метода является, что целевой белок в комплексе с молекулами липидов и детергента распределяется в надосадочной жидкости, а другие высокомолекулярные примеси - в непрореагировавшем осадке, легко отделяемом центрифугированием. Фракционирование солюбилизованного в 0.5% ДДС-Na белка с его последующим выделением в кристаллическом виде достигали в три стадии дробным низкотемпературным (-50С) осаждением метанолом, уменьшая концентрацию детергента соответственно в 2.5 и 5 раза. Окончательная стадия очистки БР заключалась в отделении белка от низкомолекулярных примесей методом гель-проникающей хроматографии, для чего БР-содержащие фракции дважды пропускали через колонку с декстрановым сефадексом G-200, уравновешенную 0.09 М Трис-боратным буфером (рН 8.35) с 0.1% ДДС-Na и 2.5 мМ ЭТДА (рис.3). Согласно разработанному методу фракционирования получено 8-10 мг 2Н-меченого БР из 1 г бактериальной биомассы, гомогенность которого удовлетворяла требованиям, предъявляемым для реконструкции мембран и подтверждалась электрофорезом в 12.5% ПААГ с 0.1% ДДС-Na, регенерацией апомембран с транс-ретиналем и обращенно-фазовой ВЭЖХ метиловых эфиров N-Днс-аминокислот. Небольшой выход БР не был препятствием для последующего масс-спектрометрического анализа, однако здесь необходимо подчеркнуть, что для обеспечения высокого выхода белка необходимо наработать большее количество сырьевой биомассы.
Статьи и публикации:
Электронная микроскопия
Просвечивающая электронная микроскопия тонких срезов миелина, а фактически и всех остальных мембран, выявляет характерную трехслойную структуру, состоящую из двух электроноплотных полос, разделенных промежутком около 80 А. Такая картина п ...
География коралловых рифов
При взгляде на карту Мирового океана, на которую нанесены места развития коралловых рифов, легко заметить одну закономерность - все они приурочены к тропической зоне. Однако в пределах этой зоны рифы имеются далеко не повсюду. Так, коралл ...
Архантропы
Иногда всех гоминин объединяют в один род Homo, к которому принадлежит и современный человек. Однако, отличие наиболее древних представителей подсемейства - архантропов - от современного человека настолько разительно, что многие антрополо ...

